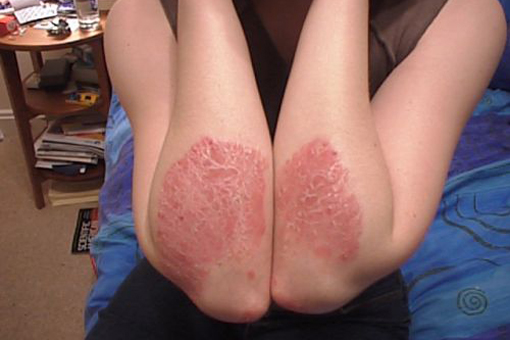
Επιβεβαιώνεται η ασφάλεια της απρεμιλάστης στη θεραπεία της ψωρίασης
Τα μακροχρόνια αποτελέσματα ασφάλειας της απρεμιλάστης, του από του στόματος εκλεκτικού αναστολέα της φωσφοδιεστεράσης4 (PDE4), από κλινικές μελέτες που βρίσκονται σε εξέλιξη, παρουσιάστηκαν στο Ετήσιο Συνέδριο της Ευρωπαϊκής Ακαδημίας Δερματολογίας και Αφροδισιολογίας (EADV) στη Βιέννη.
Spotlight
-
ΣΥΡΙΖΑ: Υπό κατάρρευση το ΕΣΥ – Με προοδευτική αντεπίθεση να βάλουμε φραγμό στη διάλυση της δημόσιας Υγείας
-

7 κινήσεις κατά της αϋπνίας
-

Σοκ με μητέρα 2 παιδιών: Της έκοψαν τα φρένα για να τη σκοτώσουν - Πώς κατάφερε να σταματήσει το αυτοκίνητο
-

Κλειστοί δρόμοι στην Αθήνα το Σάββατο για την Ολυμπιακή Φλόγα
Τα μακροχρόνια αποτελέσματα ασφάλειας της απρεμιλάστης, του από του στόματος εκλεκτικού αναστολέα της φωσφοδιεστεράσης4 (PDE4), από κλινικές μελέτες που βρίσκονται σε εξέλιξη, παρουσιάστηκαν στο Ετήσιο Συνέδριο της Ευρωπαϊκής Ακαδημίας Δερματολογίας και Αφροδισιολογίας (EADV) στη Βιέννη.
Συγκεκριμένα, παρουσιάστηκαν αναλύσεις συγκεντρωτικών δεδομένων ασφαλείας διάρκειας 156 εβδομάδων (3 ετών) από τις μελέτες ESTEEM 1 και 2 και PALACE 1-3, στις οποίες είχαν ενταχθεί ασθενείς με μέτρια έως σοβαρή κατά πλάκας ψωρίαση (ESTEEM) και ενεργό ψωριασική αρθρίτιδα (PALACE), οι οποίοι λάμβαναν θεραπεία με απρεμιλάστη 30 mg δύο φορές ημερησίως. Οι ασθενείς με ψωριασική αρθρίτιδα λάμβαναν απρεμιλάστη ως μονοθεραπεία ή σε συνδυασμό με συγχορηγούμενα τροποποιητικά της νόσου αντιρρευματικά φάρμακα (DMARDs), συμπεριλαμβανομένης της μεθοτρεξάτης.
Στη συγκεντρωτική ανάλυση ασφαλείας έως και τις 16 εβδομάδες συμπεριλήφθηκαν 2.242 ασθενείς (εικονικό φάρμακο: n=913, APR30 n=1.329), με 1.905 ασθενείς (3.527,5 έτη ασθενών) να έχουν λάβει απρεμιλάστη για διάστημα έως και 156 εβδομάδες.
Και στα δύο προγράμματα μελετών, στις 16 εβδομάδες παρακολούθησης, οι πιο συχνά εμφανιζόμενες ανεπιθύμητες ενέργειες (ΑΕ) (≥5% των ασθενών) μεταξύ των ασθενών που λάμβαναν απρεμιλάστη ήταν διάρροια, ναυτία, κεφαλαλγία, λοίμωξη του ανώτερου αναπνευστικού συστήματος και ρινοφαρυγγίτιδα. Τα περισσότερα περιστατικά διάρροιας/ναυτίας ήταν ήπιας έως μέτριας βαρύτητας, εμφανίστηκαν κατά τη διάρκεια των πρώτων 2 εβδομάδων χορήγησης της απρεμιλάστης και σε γενικές γραμμές υποχώρησαν μέσα σε έναν μήνα.
Η συχνότητα διακοπής της θεραπείας με απρεμιλάστη εξαιτίας της διάρροιας και της ναυτίας ήταν 1,3% και 1,7% αντίστοιχα, κατά τη διάρκεια των εβδομάδων 0 έως ≤52 της περιόδου έκθεσης στη θεραπεία και 0% και για τις δύο ΑΕ κατά τη διάρκεια των >104 έως ≤156 εβδομάδων.
Το προσαρμοσμένο στην έκθεση ποσοστό εμφάνισης (Exposure-Adjusted Incidence Rates, EAIR) (EAIR/100 έτη ασθενών) των ΑΕ, των σοβαρών ΑΕ και των διακοπών της θεραπείας που οφείλονταν σε ΑΕ δεν αυξήθηκε με την αυξανόμενη αθροιστική έκθεση στην απρεμιλάστη κατά τη διάρκεια της περιόδου έκθεσης (0 έως ≥156 εβδομάδες, 3.527,5 έτη ασθενών), γεγονός που επιβεβαιώθηκε από την αξιολόγηση των ποσοστών με βάση την έκθεση ανά έτος.
Η συχνότητα εμφάνισης (EAIR/100 έτη ασθενών) μειζόνων ανεπιθύμητων καρδιαγγειακών επεισοδίων (MACE), κακοηθειών και σοβαρών λοιμώξεων για τους ασθενείς που λάμβαναν απρεμιλάστη ήταν συγκρίσιμη με εκείνη των ασθενών που λάμβαναν εικονικό φάρμακο για διάστημα έως και 16 εβδομάδες και παρέμεινε χαμηλή με την παρατεταμένη έκθεση. Δεν αναφέρθηκαν σοβαρές ευκαιριακές λοιμώξεις ή κλινικά σημαντικές επιδράσεις στις εργαστηριακές μετρήσεις.
Τα ποσοστά κατάθλιψης ή αυτοκτονικότητας δεν αυξήθηκαν με την αυξανόμενη αθροιστική μακροχρόνια έκθεση στην απρεμιλάστη. Οι περισσότεροι ασθενείς που λάμβαναν απρεμιλάστη διατήρησαν το σωματικό βάρος τους με απώλεια εντός του 5% του αρχικού τους βάρους, με το 21,1% να εμφανίζει απώλεια σωματικού βάρους >5% στο διάστημα των 156 εβδομάδων της περιόδου έκθεσης στην απρεμιλάστη. Το ποσοστό διακοπής της θεραπείας λόγω απώλειας σωματικού βάρους ήταν χαμηλό.
Επίσης, μία αναδρομική ανάλυση των αποτελεσμάτων από τις μελέτες ESTEEM 1 και 2 εξέτασε τη δυναμική ενός εναλλακτικού εργαλείου για τη μέτρηση της βαρύτητας της νόσου στην ψωρίαση. Η βελτίωση στη βαθμολογία του Δείκτη Έκτασης και Σοβαρότητας της Ψωρίασης (Psoriasis Area and Severity Index, PASI) παραμένει η πιο συχνά χρησιμοποιούμενη μέθοδος αξιολόγησης της σοβαρότητας τόσο στην κλινική έρευνα όσο και στην κλινική πράξη. Ωστόσο, ο συγκεκριμένος Δείκτης έχει περιορισμούς, συμπεριλαμβανομένων της πολυπλοκότητας της βαθμολογίας και της έλλειψης προσαρμοστικότητας στις αλλαγές, γεγονός που επισημαίνει την ανάγκη βελτίωσης του τρόπου αξιολόγησης των ασθενών με ψωρίαση.
Ο συνδυασμός της Συνολικής Εκτίμησης του Ιατρού (Physician’s Global Assesment – PGA) και της Περιοχής Επιφάνειας Σώματος (Body Surface Area-BSA) -το συνδυαστικό εργαλείο PGAxBSA- είναι μία απλή μέθοδος αξιολόγησης που μετρά ουσιώδεις κλινικές ανταποκρίσεις των ασθενών με ψωρίαση στις μελέτες ESTEEM, συμπεριλαμβανομένης της ελάχιστης ενεργότητας της νόσου, και είναι ευαίσθητη στην αλλαγή ως προς τη σοβαρότητα της νόσου.
Η απρεμιλάστη είναι ένας από του στόματος μικρομοριακός αναστολέας της φωσφοδιεστεράσης 4 (PDE4), ενός ενζύμου ειδικού για την κυκλική μονοφωσφορική αδενοσίνη (cAMP). Η αναστολή της PDE4 έχει ως αποτέλεσμα την αύξηση των επιπέδων της ενδοκυτταρικής cAMP, η οποία πιστεύεται ότι ρυθμίζει εμμέσως την παραγωγή φλεγμονωδών μεσολαβητών.
Η απρεμιλάστη είναι εγκεκριμένη για τη θεραπεία της μέτριας έως σοβαρής χρόνιας κατά πλάκας ψωρίασης σε ενήλικες ασθενείς οι οποίοι δεν ανταποκρίθηκαν, ή έχουν κάποια αντένδειξη, ή εμφάνισαν μη ανοχή σε άλλη συστημική θεραπεία, συμπεριλαμβανομένης της κυκλοσπορίνης, της μεθοτρεξάτης ή του ψωραλενίου και της υπεριώδους ακτινοβολίας Α (PUVA). Ως μονοθεραπεία ή σε συνδυασμό με Τροποποιητικά της Νόσου Αντιρρευματικά Φάρμακα (DMARDs), ενδείκνυται επίσης για τη θεραπεία της ενεργού ψωριασικής αρθρίτιδας σε ενήλικες οι οποίοι είχαν ανεπαρκή ανταπόκριση ή εμφάνισαν μη ανοχή σε προηγούμενη θεραπεία με DMARD.
Αντενδείκνυται σε ασθενείς με γνωστή υπερευαισθησία στη δραστική ουσία ή σε οποιοδήποτε από τα έκδοχα αυτού του σκευάσματος, καθώς και κατά τη διάρκεια της εγκυμοσύνης.
Οι ESTEEM 1 και 2 είναι δύο μεγάλες εγκριτικές, τυχαιοποιημένες, ελεγχόμενες με εικονικό φάρμακο μελέτες Φάσης III, για την αξιολόγηση της απρεμιλάστης σε ασθενείς με διάγνωση μέτριας έως σοβαρής κατά πλάκας ψωρίασης για τουλάχιστον 12 μήνες πριν από την επιλογή για την ένταξή τους, οι οποίοι ήταν επίσης υποψήφιοι για φωτοθεραπεία και/ή συστημική θεραπεία. Περίπου 1.250 ασθενείς τυχαιοποιήθηκαν σε αναλογία 2:1 για να λάβουν είτε απρεμιλάστη 30 mg δύο φορές ημερησίως είτε εικονικό φάρμακο μετά από μία αρχική περίοδο τιτλοποίησης πέντε ημερών, για τις πρώτες 16 εβδομάδες, ακολουθούμενη από μία φάση συντήρησης στις εβδομάδες 16-32, στις οποίες οι ασθενείς που λάμβαναν εικονικό φάρμακο άλλαξαν σε θεραπεία με απρεμιλάστη 30 mg δύο φορές ημερησίως έως και την εβδομάδα 32. Η μελέτη περιλάμβανε επίσης μία τυχαιοποιημένη φάση διακοπής του φαρμάκου για τους ανταποκριθέντες ασθενείς από την εβδομάδα 32 έως την εβδομάδα 52, με βάση την αρχική τυχαιοποίησή τους στην απρεμιλάστη και την ανταπόκρισή τους σύμφωνα με το Δείκτη Έκτασης και Σοβαρότητας της Ψωρίασης. Περίπου το 30% όλων των ασθενών είχε λάβει προηγούμενη φωτοθεραπεία και το 54% είχε λάβει συμβατική συστημική ή/και βιολογική θεραπεία.
Οι PALACE 1, 2 και 3 είναι τρεις εγκριτικές, πολυκεντρικές, διπλά τυφλές, ελεγχόμενες με εικονικό φάρμακο μελέτες παράλληλων ομάδων Φάσης III, με δύο ομάδες δραστικής θεραπείας. Σε αυτές τις μελέτες, περίπου 1.500 ασθενείς τυχαιοποιήθηκαν σε αναλογία 1:1:1 για να λάβουν απρεμιλάστη 20 mg δύο φορές ημερησίως ή απρεμιλάστη 30 mg δύο φορές ημερησίως ή εικονικό φάρμακο, για 16 εβδομάδες. Την εβδομάδα 16, κάποιοι ασθενείς που λάμβαναν εικονικό φάρμακο τυχαιοποιήθηκαν σε μία από τις δύο ομάδες της απρεμιλάστης, ενώ οι υπόλοιποι συνέχισαν να λαμβάνουν εικονικό φάρμακο έως και την εβδομάδα 24. Μετά την εβδομάδα 24, οι ασθενείς ξεκίνησαν μία επακόλουθη μακροχρόνια φάση ανοιχτής αγωγής με δραστική θεραπεία. Στις μελέτες PALACE 1, 2 και 3 εντάχθηκε ένα ευρύ φάσμα ασθενών με ενεργό ψωριασική αρθρίτιδα, οι οποίοι είχαν κατά το παρελθόν αντιμετωπιστεί με από του στόματος τροποποιητικά της νόσου αντιρρευματικά φάρμακα (DMARD), και/ή βιολογικούς παράγοντες, ενώ σε ορισμένους ασθενείς προηγούμενη θεραπεία με αναστολέα του παράγοντα νέκρωσης του όγκου (TNF) είχε αποτύχει. Κατά την έναρξη των μελετών, το 65,2 του ποσοστού των ασθενών που λάμβαναν απρεμιλάστη στις PALACE 1, 2 και 3 λάμβαναν επίσης DMARD, συμπεριλαμβανομένης της μεθοτρεξάτης.
Στο σύνολό του, το πρόγραμμα PALACE είναι το μεγαλύτερο μέχρι σήμερα πρόγραμμα κλινικών μελετών για την ψωριασική αρθρίτιδα που έχει υποβληθεί για έγκριση άδειας κυκλοφορίας στις ρυθμιστικές αρχές.
health.in.gr
Ακολουθήστε το in.gr στο Google News και μάθετε πρώτοι όλες τις ειδήσεις





























 Αριθμός Πιστοποίησης Μ.Η.Τ.232442
Αριθμός Πιστοποίησης Μ.Η.Τ.232442