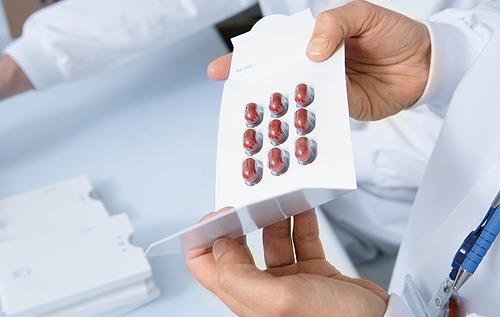
Ασφαλής για την καρδιαγγειακή υγεία των διαβητικών η λιξισενατίδη
Αποδεδειγμένη καρδιαγγειακή ασφάλεια σε ατομα με διαβήτη τύπου ΙΙ και υψηλό καρδιαγγειακό κίνδυνο, έχει η λιξισενατίδη, σύμφωνα με τα πλήρη αποτελέσματα της μελέτης Φάσης ΙΙΙb ELIXA που παρουσιάστηκαν κατά τη διάρκεια συμποσίου στα πλαίσια του 75ου Επιστημονικού Συνεδρίου της Αμερικανικής Διαβητολογικής Εταιρείας, στη Βοστώνη.
Spotlight
-
![Φρενάρουν οι τιμές στο ελαιόλαδο – Το report του Διεθνούς Συμβουλίου Ελαιοκομίας [γραφήματα]](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%20315%20220%22%3E%3C/svg%3E)
Φρενάρουν οι τιμές στο ελαιόλαδο – Το report του Διεθνούς Συμβουλίου Ελαιοκομίας [γραφήματα]
-

Από τι πέθανε το 4 μηνών βρέφος στο Διδυμότειχο - «Περιμένουμε τα αποτελέσματα των ιστολογικών εξετάσεων»
-

«Είναι ακόμη πολύ όμορφη, μοιάζει σαν να είναι ζωντανή» - Συγκλονίζουν οι γονείς της Σάνι Λουκ
-

«Ούτε μία συγγνώμη δεν μας είπαν» - Ξεσπούν οι γονείς μαθητών στη Λαμία που υπέστησαν τροφική δηλητήριαση
Αποδεδειγμένη καρδιαγγειακή ασφάλεια σε ατομα με διαβήτη τύπου ΙΙ και υψηλό καρδιαγγειακό κίνδυνο, έχει η λιξισενατίδη, σύμφωνα με τα πλήρη αποτελέσματα της μελέτης Φάσης ΙΙΙb ELIXA που παρουσιάστηκαν κατά τη διάρκεια συμποσίου στα πλαίσια του 75ου Επιστημονικού Συνεδρίου της Αμερικανικής Διαβητολογικής Εταιρείας, στη Βοστώνη.
Η λιξισενατίδη πέτυχε το προκαθορισμένο κριτήριο της μη κατωτερότητας έναντι του εικονικού φαρμάκου για το σύνθετο πρωτεύον τελικό σημείο των καρδιαγγειακών θανάτων, του μη-θανατηφόρου εμφράγματος του μυοκαρδίου, του μη θανατηφόρου αγγειακού εγκεφαλικού επεισοδίου και της νοσηλείας για ασταθή στηθάγχη, χωρίς να καταδείξει υπεροχή.
Τα πλήρη αποτελέσματα θα συμπεριληφθούν στην αίτηση για την έγκριση κυκλοφορίας της λιξισενατίδης, που αναμένεται να υποβληθεί εκ νέου προς τον Αμερικανικό Οργανισμό Τροφίμων και Φαρμάκων (FDA) κατά το τρίτο τρίμηνο του 2015.
Η λιξισενατίδη είναι ένας άπαξ ημερησίως χορηγούμενος γευματικός αγωνιστής του υποδοχέα του GLP-1 για τη θεραπεία του σακχαρώδη διαβήτη τύπου ΙΙ. Το GLP-1 είναι μία φυσική πεπτιδική ορμόνη που εκκρίνεται στο σώμα εντός λίγων λεπτών από τη λήψη ενός γεύματος. Είναι γνωστό ότι καταστέλλει την έκκριση γλυκαγόνης από τα παγκρεατικά α-κύτταρα και διεγείρει τη γλυκοζοεξαρτώμενη έκκριση ινσουλίνης από τα παγκρεατικά β-κύτταρα.
Η λιξισενατίδη έχει εγκριθεί στην Ευρώπη το 2013 για τη θεραπεία ενηλίκων ασθενών με σακχαρώδη διαβήτη τύπου ΙΙ για την επίτευξη γλυκαιμικού ελέγχου σε συνδυασμό με από του στόματος φαρμακευτικά σκευάσματα που μειώνουν τα επίπεδα γλυκόζης και/ή βασική ινσουλίνη όταν παράλληλα με δίαιτα και άσκηση, δεν πετυχαίνουν επαρκή γλυκαιμικό έλεγχο.
Η λιξισενατίδη έχει λάβει άδεια κυκλοφορίας σε πάνω από 50 χώρες παγκοσμίως για την θεραπεία ενηλίκων ασθενών που πάσχουν από σακχαρώδη διαβήτη τύπου ΙΙ και κυκλοφορεί στην αγορά της Ευρώπης, της Ιαπωνίας, του Μεξικού και άλλων χωρών.
Η μελέτη ELIXA είναι η πρώτη μελέτη καταγραφής καρδιαγγειακών συμβαμάτων αναφορικά με την αγωγή με ένα αγωνιστή του υποδοχέα του GLP-1. Ήταν μία τυχαιοποιημένη, διπλή τυφλή, παράλληλων ομάδων μελέτη που σχεδιάστηκε για να αξιολογήσει τον καρδιαγγειακό κίνδυνο, συγκρίνοντας τη λιξισενατίδη με το εικονικό φάρμακο σε πληθυσμό ενηλίκων με υψηλό κίνδυνο για διαβήτη τύπου ΙΙ. Περισσότεροι από 6.000 ενήλικες με διαβήτη τύπου 2ΙΙ και υψηλό καρδιαγγειακό κίνδυνο (δηλαδή, ασθενείς που είχαν υποστεί οξύ στεφανιαίο σύνδρομο) συμμετείχαν στη μελέτη. Η ELIXA ξεκίνησε τον Ιούνιο του 2010 και ολοκληρώθηκε το 2015.
Η λιξισενατίδη πέτυχε το προκαθορισμένο κριτήριο της μη κατωτερότητας έναντι του εικονικού φαρμάκου για το σύνθετο πρωτεύον τελικό σημείο Μείζονος Καρδιαγγειακού Συμβάματος (ΜΚΣ): καρδιαγγειακός θάνατος, μη θανατηφόρο έμφραγμα του μυοκαρδίου, μη θανατηφόρο αγγειακό εγκεφαλικό επεισόδιο και νοσηλεία για ασταθή στηθάγχη (Αναλογία Κινδύνου [95% CI]: 1,017 [0,886 έως 1,168]). Εφόσον το ανώτερο όριο του 95% CI ήταν μεγαλύτερο από το 1,0, η υπεροχή έναντι του εικονικού φαρμάκου στη μείωση του σύνθετου πρωτεύοντος καταληκτικού σημείου δεν επετεύχθη.
Η καρδιαγγειακή ασφάλεια της λιξισενατίδης επιβεβαιώθηκε επίσης από περαιτέρω αναλύσεις (π.χ. ΜΚΣ Αναλογία Κινδύνου [95% Cl]: 1,02 [0,887εως 1,72]) ενώ δεν υπήρξε καμία ένδειξη για αυξημένο κίνδυνο καρδιακής ανεπάρκειας (Αναλογία Κινδύνου [95% Cl]: 0,96 [0,75 – 1,23].
Αναφορικά με την ασφάλεια του φαρμάκου που δεν σχετίζεται με το καρδιαγγειακό, παρατηρήθηκαν παγκρεατίτιδα (0,2% με λιξισενατίδη και 0,3% με το εικονικό φάρμακο), καρκίνος του παγκρέατος (<0,1% με λιξισενατίδη και 0,3% με το εικονικό φάρμακο), σοβαρή συμπτωματική υπογλυκαιμία (0,3 συμβάντα ανά 100 ασθενοέτη με λιξισενατίδη και 0,6 ανά 100 ασθενοέτη με το εικονικό φάρμακο), κακοήθεια (2,9% με λιξισενατίδη και 2,6% με το εικονικό φάρμακο), αλλεργικές αντιδράσεις που συνδέονται με φάρμακο (0,2% τόσο με λιξισενατίδη όσο και με το εικονικό φάρμακο.
«Η σημασία του προσδιορισμού της καρδιαγγειακής ασφάλειας των φαρμάκων για τον διαβήτη, όπως ορίζεται στις κατευθυντήριες γραμμές του FDA που εκδόθηκαν το 2008, είναι ευρέως αναγνωρισμένη. Πολλοί άνθρωποι σε όλο τον κόσμο υποβάλλονται σε θεραπεία με αγωνιστές του υποδοχέα του GLP-1 χωρίς να είναι γνωστή η επίδρασή τους στο καρδιαγγειακό. Η μελέτη ELIXA πάει ένα βήμα πέρα από τις κατευθύνσεις του FDA καθώς παρέχει στοιχεία που σχετίζονται με την καρδιακή ανεπάρκεια και άλλα συμπεράσματα που δεν είναι προς το παρόν διαθέσιμα για άλλον αγωνιστή του υποδοχέα του GLP-1. Τα στοιχεία μας προσφέρουν στην ιατρική κοινότητα, τους ασθενείς και τους φροντιστές, πληροφορίες για την καλύτερη χρήση της λιξισενατίδης, με ασφάλεια για τον καλύτερο γλυκαιμικό έλεγχο», σύμφωνα με τον Δρ Μαρκ Πφεφερ, καθηγητή Ιατρικής στην Ιατρική Σχολή του Χάρβαρντ, κύριο συνεργάτη στο Τμήμα Καρδιαγγειακής Ιατρικής του Brigham and Women’s Hospital και πρόεδρο της Οργανωτικής Επιτροπής για τη μελέτη ELIXA.
health.in.gr
Ακολουθήστε το in.gr στο Google News και μάθετε πρώτοι όλες τις ειδήσεις

![Ελαιόλαδο: Πώς διαμορφώνονται οι τιμές παραγωγού – Στοιχεία για το παγκόσμιο εμπόριο [γραφήματα]](https://www.ot.gr/wp-content/uploads/2024/05/olive-oil-968657_1280-300x300.jpg)
![Φρενάρουν οι τιμές στο ελαιόλαδο – Το report του Διεθνούς Συμβουλίου Ελαιοκομίας [γραφήματα]](https://www.in.gr/wp-content/uploads/2024/05/olive-oil-968657_1280-315x220.jpg)

































 Αριθμός Πιστοποίησης Μ.Η.Τ.232442
Αριθμός Πιστοποίησης Μ.Η.Τ.232442