ΕΕ: Εγκρίθηκε στοχευμένη βιολογική θεραπεία για την ατοπική δερματίτιδα
H Ευρωπαϊκή Επιτροπή παραχώρησε άδεια κυκλοφορίας για το dupilumab, για χρήση σε ενήλικες με μέτρια έως σοβαρή Ατοπική Δερματίτιδα (ΑΔ) οι οποίοι είναι κατάλληλοι για να λάβουν συστηματική θεραπεία.
Spotlight
-

Η ελληνική παραλία σύμβολο μιας ολόκληρης εποχής – Ένα εντυπωσιακό βίντεο από ψηλά
-

Κακή εξέλιξη με τον ιό H5N1 - Εντοπίστηκε σε αγελαδινό γάλα
-

Καθηγητής του Χάρβαρντ: «Απεχθάνομαι το ιρανικό καθεστώς, αλλά έχει δίκιο – Ένοχες οι ΗΠΑ»
-

Υποψήφια του Μελανσόν στις ευρωεκλογές, καλείται να ζητήσει «συγγνώμη για τρομοκρατία» - Τι της αποδίδουν;
H Ευρωπαϊκή Επιτροπή παραχώρησε άδεια κυκλοφορίας για το dupilumab, για χρήση σε ενήλικες με μέτρια έως σοβαρή Ατοπική Δερματίτιδα (ΑΔ) οι οποίοι είναι κατάλληλοι για να λάβουν συστηματική θεραπεία.
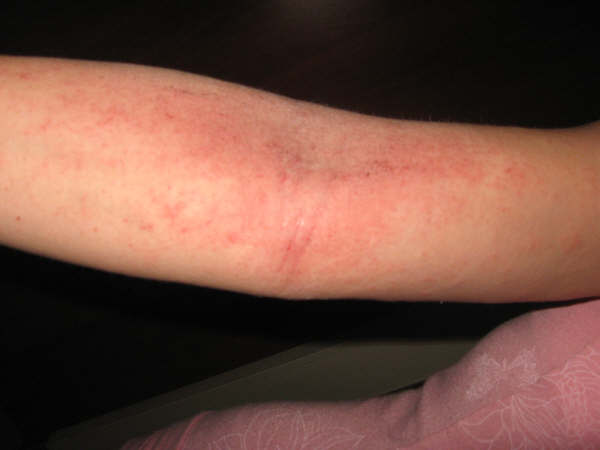
Η ατοπική δερματίτιδα, μία μορφή εκζέματος, αποτελεί μία χρόνια φλεγμονώδη νόσο με συμπτώματα που συχνά παρουσιάζονται ως εξάνθημα στην επιφάνεια του δέρματος. Η μέτρια έως σοβαρή ατοπική δερματίτιδα χαρακτηρίζεται από εξανθήματα, που συχνά καλύπτουν μεγάλο τμήμα του σώματος, και είναι δυνατό να συνοδεύεται από έντονο, συνεχή κνησμό και ξηρότητα, σκάσιμο, ερυθρότητα, δημιουργία εφελκίδων και εξιδρώματος. Ο κνησμός είναι ένα από τα πιο δύσκολα συμπτώματα των ασθενών που ενδέχεται να καταστεί εξουθενωτικό. Επιπλέον, οι ασθενείς με μέτρια έως σοβαρή ατοπική δερματίτιδα παρουσιάζουν μειωμένη ποιότητα ζωής, που περιλαμβάνει διαταραχές ύπνου, καθώς και συμπτώματα αυξημένου άγχους και κατάθλιψης εξαιτίας της νόσου.
Το dupilumab είναι ένα ανθρώπινο μονοκλωνικό αντίσωμα που έχει σχεδιαστεί για να αναστέλλει την υπερενεργή σηματοδότηση δύο βασικών κυτοκινών, της IL-4 και της IL-13, οι οποίες πιστεύεται ότι αποτελούν σημαντικό παράγοντα της επίμονης υποκείμενης φλεγμονής στην ατοπική δερματίτιδα και σε ορισμένες άλλες αλλεργικές ή ατοπικές νόσους. Το dupilumab θα διατίθεται σε προγεμισμένη σύριγγα και θα μπορεί να χορηγείται υποδορίως από τον ίδιο τον ασθενή κάθε δεύτερη βδομάδα μετά από μία αρχική δόση φόρτισης. Το dupilumab μπορεί να χρησιμοποιείται με ή χωρίς τοπικά κορτικοστεροειδή.
Το dupilumab έχει εγκριθεί στις ΗΠΑ για τη θεραπεία ενηλίκων ασθενών με μέτρια έως σοβαρή ατοπική δερματίτιδα (έκζεμα) των οποίων η νόσος δεν ελέγχεται επαρκώς με συνταγογραφούμενες θεραπείες που εφαρμόζονται τοπικά στο δέρμα ή στην περίπτωση που οι συγκεκριμένες θεραπείες δεν ενδείκνυνται. Το dupilumab μπορεί να χρησιμοποιείται με ή χωρίς τοπικά κορτικοστεροειδή. Δεν είναι γνωστό εάν το dupilumab είναι ασφαλές και αποτελεσματικό για χρήση σε παιδιά.
Η έγκριση του dupilumab βασίστηκε σε στοιχεία από το παγκόσμιο κλινικό πρόγραμμα LIBERTY AD, στο οποίο συμμετείχαν περίπου 3.000 ασθενείς. Οι κλινικές μελέτες του προγράμματος LIBERTY AD είναι οι εξής: SOLO 1, SOLO 2, CHRONOS, SOLO-CONTINUE και CAFÉ.Οι μελέτες εξέτασαν τη χρήση του dupilumab είτε ως μονοθεραπεία (SOLO 1, SOLO 2 και SOLO-CONTINUE) είτε σε συνδυασμό με τοπικά κορτικοστεροειδή (CHRONOS ή CAFÉ) σε ασθενείς με μέτρια έως σοβαρή ατοπική δερματίτιδα οι οποίοι δεν ελέγχονταν επαρκώς με συνταγογραφούμενες θεραπείες τοπικής εφαρμογής ή ανοσοκατασταλτικά φάρμακα, όπως η κυκλοσπορίνη, ή στην περίπτωση που οι συγκεκριμένες θεραπείες δεν ενδείκνυντο. Σε όλες τις μελέτες, το dupilumab ως μονοθεραπεία ή σε συνδυασμό με τοπικά κορτικοστεροειδή πέτυχε τα πρωτεύοντα και κύρια δευτερεύοντα καταληκτικά σημεία.
Οι πιο συχνά αναφερόμενες ανεπιθύμητες ενέργειες που παρατηρήθηκαν σε υψηλότερο ποσοστό σε σχέση με το εικονικό φάρμακο στην ομάδα θεραπείας με dupilumab (>1%) ήταν αντιδράσεις στο σημείο έγχυσης, φλεγμονή του οφθαλμού και του βλεφάρου, που περιλαμβάνει ερυθρότητα, οίδημα και κνησμό, καθώς και ψυχρά έλκη στο στόμα ή τα χείλη.
Επί του παρόντος, το dupilumab αξιολογείται στο πλαίσιο ενός ολοκληρωμένου προγράμματος ανάπτυξης για την ατοπική δερματίτιδα το οποίο περιλαμβάνει μελέτες σε παιδιά με σοβαρή ατοπική δερματίτιδα (ηλικίας 6 μηνών έως 11 ετών) και σε έφηβους με μέτρια έως σοβαρή ατοπική δερματίτιδα (ηλικίας 12 έως 17 ετών). Οι δυνητικές αυτές χρήσεις βρίσκονται υπό δοκιμή και η ασφάλεια και αποτελεσματικότητά τους δεν έχουν αξιολογηθεί ή επιβεβαιωθεί από καμία ρυθμιστική αρχή.
Το dupilumab αξιολογείται επίσης για άλλες φλεγμονώδεις νόσους στις οποίες πιστεύεται ότι οι κυτοκίνες IL- 4 και IL-13 αποτελούν σημαντικό παράγοντα, μεταξύ των οποίων το επίμονο μη ελεγχόμενο άσθμα (Φάσης 3), η ρινική πολυποδίαση (Φάσης 3) και ηωσινοφιλική οισοφαγίτιδα (Φάσης 2). Οι δυνητικές αυτές χρήσεις βρίσκονται υπό δοκιμή και η ασφάλεια και αποτελεσματικότητά τους δεν έχουν αξιολογηθεί από καμία ρυθμιστική αρχή.
health.in.gr
Ακολουθήστε το in.gr στο Google News και μάθετε πρώτοι όλες τις ειδήσεις






![Φυσικό αέριο: Γιατί είναι δύσκολη η απεξάρτηση από τη Ρωσία – Τα εμπόδια [Χάρτης]](https://www.ot.gr/wp-content/uploads/2022/07/gas-1-1-300x300.jpg)
























 Αριθμός Πιστοποίησης Μ.Η.Τ.232442
Αριθμός Πιστοποίησης Μ.Η.Τ.232442