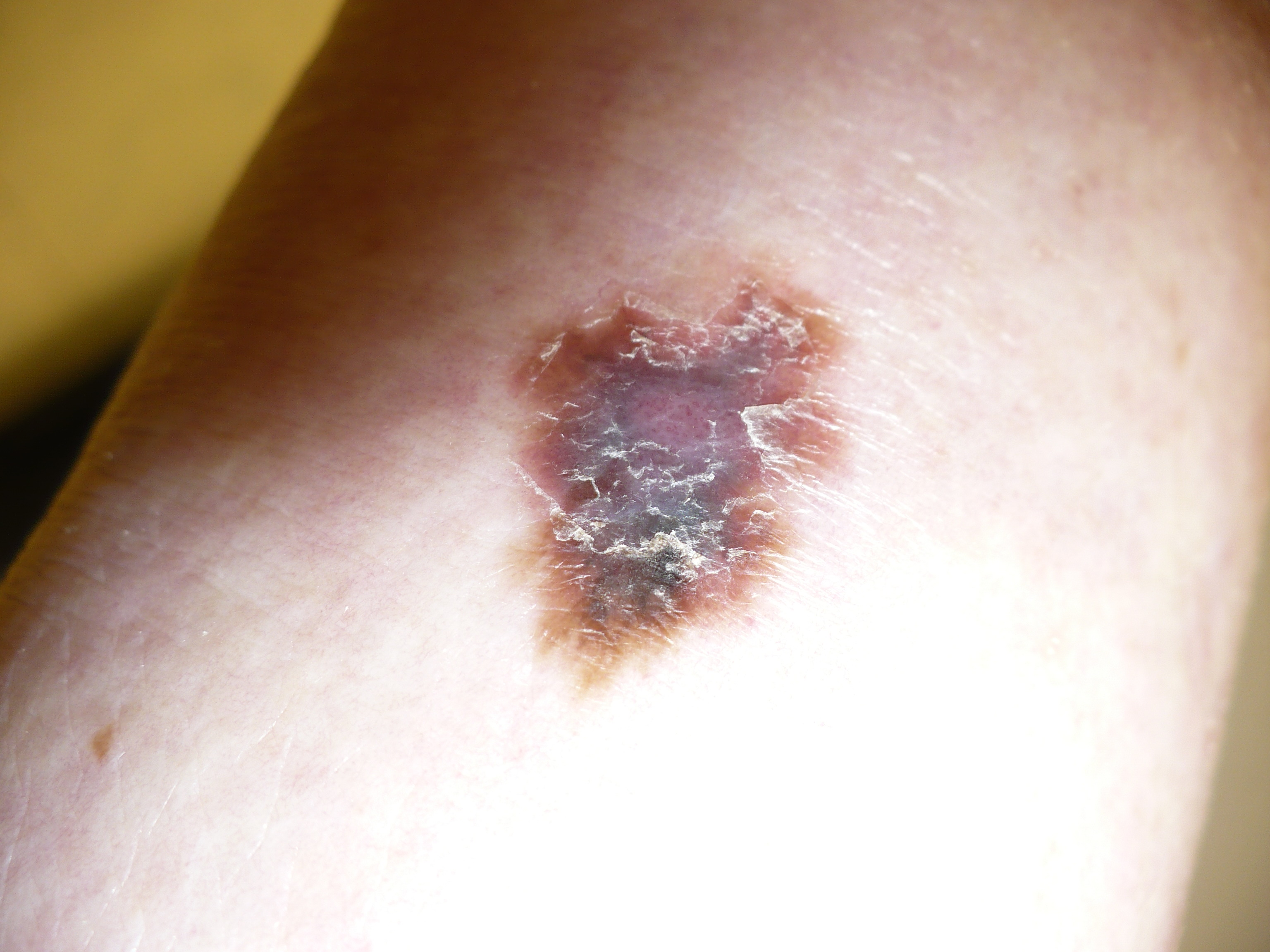
Νέα θεραπεία για το μεταστατικό μελάνωμα ενέκρινε η Ευρωπαϊκή Επιτροπή
Η Ευρωπαϊκή Επιτροπή ενέκρινε τον αναστολέα της πρωτεΐνης PD-1, nivolumab, για χρήση, τόσο σε θεραπεία πρώτης γραμμής, όσο και σε ασθενείς που είχαν λάβει προηγούμενη θεραπεία για προχωρημένο (μη εγχειρήσιμο ή μεταστατικό) μελάνωμα.
Spotlight
-

Απόφοιτη Πανεπιστημίου ορκίστηκε ευχαριστώντας την… Άννα Βίσση
-

Η τέχνη του φλερτ μαθαίνεται- Εσείς, ακόμη να την κατακτήσετε;
-

To μπλουζάκι του καλοκαιριού βρέθηκε και το φορούν ήδη όλοι, από την Zendaya στον John F. Kennedy Jr. και τούμπαλιν
-

Μοναδικό timelapse βίντεο με την μεταφορά της αφρικανικής σκόνης στη χώρα μας
Η Ευρωπαϊκή Επιτροπή ενέκρινε τον αναστολέα της πρωτεΐνης PD-1, nivolumab, για χρήση, τόσο σε θεραπεία πρώτης γραμμής, όσο και σε ασθενείς που είχαν λάβει προηγούμενη θεραπεία για προχωρημένο (μη εγχειρήσιμο ή μεταστατικό) μελάνωμα.
Η έγκριση επιτρέπει την κυκλοφορία του nivolumab και στα 28 κράτη-μέλη της ΕΕ και είναι επακόλουθο της ταχείας διαδικασίας αξιολόγησης από την Επιτροπή Φαρμακευτικών Προϊόντων για Ανθρώπινη Χρήση (CHMP) η οποία ανακοινώθηκε στις 24 Απριλίου 2015 και βασίζεται στους ισχύοντες κανονισμούς, ακολουθώντας τις οδηγίες για «φαρμακευτικά προϊόντα, τα οποία παρουσιάζουν μεγάλο ενδιαφέρον από πλευράς της δημόσιας υγείας και ιδιαίτερα από πλευράς καινοτομίας στη θεραπεία».
Το nivolumab είναι ο μόνος αναστολέας της πρωτεΐνης PD-1, σημείου ελέγχου του ανοσοποιητικού συστήματος, που αξιολογήθηκε με ταχεία διαδικασία αξιολόγησης στην Ευρώπη και είναι η πρώτη έγκριση που χορηγείται από την Ευρωπαϊκή Επιτροπή για έναν αναστολέα της πρωτεΐνης PD-1 για οποιαδήποτε μορφή καρκίνου.
Το μελάνωμα είναι μια μορφή καρκίνου του δέρματος που χαρακτηρίζεται από την ανεξέλεγκτη ανάπτυξη των κυττάρων που παράγουν τη χρωστική ουσία μελανίνη (μελανοκύτταρα) και τα οποία βρίσκονται στο δέρμα. Το μεταστατικό μελάνωμα είναι η πιο θανατηφόρα μορφή της νόσου και εμφανίζεται όταν ο καρκίνος διαφύγει πέρα από την επιφάνεια του δέρματος σε άλλα όργανα, όπως στους λεμφαδένες, τους πνεύμονες, τον εγκέφαλο ή άλλες περιοχές του σώματος. Το μελάνωμα είναι η ένατη πιο συχνή μορφή καρκίνου στην Ευρώπη, με περίπου 100.000 νέες περιπτώσεις να διαγιγνώσκονται κάθε χρόνο και με αναφορές για περισσότερους από 20.000 θανάτους.
Η συχνότητα εμφάνισης του μελανώματος εξακολουθεί να αυξάνεται σε σχεδόν όλες τις ευρωπαϊκές χώρες, με μια εκτιμώμενη αναλογία ένας στους πέντε ασθενείς να προβλέπεται να αναπτύξει μεταστατική, ή προχωρημένη, νόσο. Σύμφωνα με τα δεδομένα, η πρόγνωση για τους ασθενείς με μεταστατικό μελάνωμα προχωρημένου σταδίου είναι δυσμενής: το ποσοστό επιβίωσης κατά μέσο όρο για το στάδιο IV είναι μόλις 6 μήνες με ετήσιο ποσοστό θνησιμότητας 75%.
Η έγκριση της Ευρωπαϊκής Επιτροπής βασίστηκε σε δεδομένα από δύο μελέτες Φάσης 3 (CheckMate -066, -037). Συνολικά, οι μελέτες διερεύνησαν το nivolumab με βάση τις γραμμές θεραπείας και τη κατάσταση μεταλλάξεων με σταθερή δόση 3 mg/kg κάθε δύο εβδομάδες, η οποία τεκμηριώθηκε επαρκώς στο πρόγραμμα κλινικής ανάπτυξης φάσης III για το nivolumab.
Η CheckMate-066 είναι μια τυχαιοποιημένη, διπλά τυφλή μελέτη Φάσης 3, η οποία συνέκρινε το nivolumab (n=210) έναντι χημειοθεραπείας με δακαρβαζίνη (DTIC) (n=208) σε πρωτοθεραπευόμενους ασθενείς με προχωρημένο μελάνωμα. Είναι η πρώτη μελέτη Φάσης 3 ενός υπό διερεύνηση αναστολέα της πρωτεΐνης PD-1, σημείου ελέγχου του ανοσοποιητικού συστήματος, που επέδειξε όφελος συνολικής επιβίωσης στο προχωρημένο μελάνωμα, με ποσοστό επιβίωσης ενός έτους 73% για το nivolumab έναντι 42% για τη DTIC, ενώ παράλληλα παρατηρήθηκε κατά 58% μείωση του κινδύνου θανάτου για τους ασθενείς που έλαβαν θεραπεία με nivolumab. Το ποσοστό αντικειμενικής ανταπόκρισης ήταν επίσης σημαντικά υψηλότερο για το nivolumab σε σχέση με τη DTIC (40% έναντι 14%).
Οι πιο συχνές ανεπιθύμητες ενέργειες που σχετίστηκαν με τη θεραπεία με nivolumab ήταν κόπωση (20%), κνησμός (17%) και ναυτία (16,5%). Οι συχνές ανεπιθύμητες ενέργειες που παρατηρήθηκαν στο σκέλος DTIC ήταν σε συμφωνία με εκείνες που αναφέρθηκαν σε προηγούμενες αναφορές και περιελάμβαναν ναυτία (41,5%), έμετο (21%), κόπωση (15%), διάρροια (15%) και αιματολογικές τοξικότητες. Σε κανένα σκέλος θεραπείας δεν αναφέρθηκαν περιστατικά θανάτου που να αποδίδονται στην τοξικότητα του φαρμάκου της μελέτης.
Η δεύτερη μελέτη, η CheckMate-037, είναι μια τυχαιοποιημένη, ελεγχόμενη, ανοιχτή μελέτη Φάσης 3 του nivolumab έναντι ICC (χημειοθεραπείας κατ’ επιλογήν του ερευνητή, είτε μονοθεραπεία με δακαρβαζίνη είτε συνδυασμός καρβοπλατίνης και πακλιταξέλης) σε ασθενείς με προχωρημένο μελάνωμα, οι οποίοι είχαν λάβει προηγούμενη θεραπεία με ipilimumab και, σε περίπτωση που είχαν μετάλλαξη BRAF, είχαν λάβει θεραπεία με αναστολέα BRAF.
Σε μία προγραμματισμένη ενδιάμεση ανάλυση του ποσοστού αντικειμενικής ανταπόκρισης, παρατηρήθηκε βελτίωση στο ποσοστό αντικειμενικής ανταπόκρισης στο 32% στο σκέλος nivolumab (95% CI, 23,5% -40,8%) έναντι 11% στο σκέλος χημειοθεραπείας επιλογής του ερευνητή (95% CI, 3,5% -23,1%). Η πλειοψηφία των ανταποκρίσεων (95%) ήταν σε εξέλιξη στους ασθενείς στους οποίους χορηγήθηκε nivolumab. Οι ανταποκρίσεις στη θεραπεία με nivolumab παρατηρήθηκαν σε ασθενείς με ή χωρίς μετάλλαξη BRAF και ανεξάρτητα της έκφρασης PD-L1.
Διακοπή της θεραπείας λόγω των σχετιζόμενων με το φάρμακο ανεπιθύμητων ενεργειών οποιουδήποτε βαθμού σημειώθηκε στο 2% των ασθενών που έλαβαν θεραπεία με nivolumab και στο 8% των ασθενών στους οποίους χορηγήθηκε ICC. Δεν αναφέρθηκαν περιστατικά θανάτου που να σχετίζονται με τοξικότητα του φαρμάκου της μελέτης.
Η έγκριση βασίστηκε επίσης σε στοιχεία από τη μελέτη Φάσης 1b (Μελέτη -003) στο υποτροπιάζον προχωρημένο ή μεταστατικό μελάνωμα, μέσα από την οποία χαρακτηρίστηκε για πρώτη φορά η σχέση οφέλους/κινδύνου του nivolumab στο προχωρημένο μελάνωμα. Από τους 306 ασθενείς που είχαν λάβει προηγούμενη θεραπεία που συμμετείχαν στη μελέτη, οι 107 είχαν διαγνωστεί με μελάνωμα και έλαβαν nivolumab σε δόση 0,1 mg/kg, 0,3 mg/kg, 1 mg/kg, 3 mg/kg, ή 10 mg/kg για μέγιστο χρονικό διάστημα 2 ετών. Σε αυτό τον πληθυσμό ασθενών, αναφέρθηκε αντικειμενική ανταπόκριση σε 33 ασθενείς (31%), με διάμεση διάρκεια ανταπόκρισης 22,9 μήνες (95% CI: 17,0, NR). Το διάμεσο διάστημα ελευθερο νόσου ήταν 3,7 μήνες (95% CI: 1,9, 9,3). Η διάμεση συνολική επιβίωση ήταν 17,3 μήνες (95% CI: 12,5, 36,7) και τα εκτιμώμενα ποσοστά συνολικής επιβίωσης ήταν 63% (95% CI: 53, 71) στο 1 έτος, 48% (95% CI: 38, 57), στα 2 έτη και 41% (95% CI: 31, 51) στα 3 έτη.
«Τα δεδομένα φάσης ΙΙΙ που υποστηρίζουν την έγκριση του nivolumab καταδεικνύουν την ανωτερότητα του τόσο ως προς τη συνολική επιβίωση όσο και ως προς το ποσοστό ανταπόκρισης έναντι της καθιερωμένης θεραπείας, σε ασθενείς με προχωρημένο μελάνωμα που έλαβαν για πρώτη φορά θεραπεία. Αποτελεί ένα σημαντικό βήμα για την παροχή μιας νέας θεραπευτικής επιλογής σε ασθενείς με προχωρημένο μελάνωμα στην Ευρωπαϊκή Ένωση, ιδίως εάν ληφθεί υπόψη ότι τα μακροπρόθεσμα οφέλη αποτελούν σε μεγάλο βαθμό μη επιτεύξιμους στόχους σε αυτή την θεραπευτική κατηγορία», σχολίασε ο Δρ Ντιρκ Σαντεντορφ, διευθυντής της Δερματολογικής Κλινικής του Πανεπιστημίου του Έσσεν της Γερμανίας.
health.in.gr
Ακολουθήστε το in.gr στο Google News και μάθετε πρώτοι όλες τις ειδήσεις


































 Αριθμός Πιστοποίησης Μ.Η.Τ.232442
Αριθμός Πιστοποίησης Μ.Η.Τ.232442